 ¿Cómo alimentan las baterías nuestro mundo? Ver más imágenes de la batería.
¿Cómo alimentan las baterías nuestro mundo? Ver más imágenes de la batería. Imagine un mundo en el que todo lo que usa electricidad tuviera que estar enchufado. Las linternas, los audífonos, los teléfonos celulares y otros dispositivos portátiles estarían atados a los enchufes eléctricos, haciéndolos incómodos y engorrosos. Los autos no podían encenderse con el simple giro de una llave; Se requeriría un arranque extenuante para que los pistones se muevan. Los cables estarían tendidos por todas partes, creando un peligro para la seguridad y un desorden antiestético. Afortunadamente, las baterías nos brindan una fuente de energía móvil que hace posibles muchas de las comodidades modernas.
Si bien hay muchos tipos diferentes de baterías, el concepto básico por el cual funcionan sigue siendo el mismo. Cuando un dispositivo se conecta a una batería, se produce una reacción que produce energía eléctrica. Esto se conoce como una reacción electroquímica . El físico italiano Conde Alessandro Volta descubrió por primera vez este proceso en 1799 cuando creó una batería simple a partir de placas de metal y cartón o papel empapado en salmuera. Desde entonces, los científicos han mejorado mucho el diseño original de Volta para crear baterías hechas de una variedad de materiales que vienen en una multitud de tamaños.
Hoy en día, las baterías están a nuestro alrededor. Alimentan nuestros relojes de pulsera durante meses a la vez. Mantienen funcionando nuestros despertadores y teléfonos, incluso si se va la electricidad. Hacen funcionar nuestros detectores de humo, maquinillas de afeitar eléctricas, taladros eléctricos, reproductores de mp3, termostatos, y la lista continúa. Si está leyendo este artículo en su computadora portátil o teléfono inteligente, ¡incluso puede estar usando baterías en este momento! Sin embargo, debido a que estos paquetes de energía portátiles son tan frecuentes, es muy fácil darlos por sentado. Este artículo le dará una mayor apreciación de las baterías al explorar su historia, así como las partes, reacciones y procesos básicos que las hacen funcionar. Así que corta ese cable y haz clic en nuestra guía informativa para recargar tus conocimientos sobre baterías.
Historial de batería
 La historia de las baterías se remonta a 1800. Aprenda sobre la historia de las baterías y descubra cómo Daniell batería de celda está construida.
La historia de las baterías se remonta a 1800. Aprenda sobre la historia de las baterías y descubra cómo Daniell batería de celda está construida. Las baterías han existido por más tiempo de lo que piensas. En 1938, el arqueólogo Wilhelm Konig descubrió algunas vasijas de barro peculiares mientras excavaba en Khujut Rabu, en las afueras de la actual Bagdad, Irak. Los frascos, que miden aproximadamente 5 pulgadas (12,7 centímetros) de largo, contenían una barra de hierro recubierta de cobre y databan de alrededor del 200 a.C. Las pruebas sugirieron que los recipientes alguna vez se llenaron con una sustancia ácida como vinagre o vino, lo que llevó a Konig a creer que estos recipientes eran baterías antiguas. Desde este descubrimiento, los estudiosos han producido réplicas de las ollas que, de hecho, son capaces de producir una carga eléctrica. Estas "baterías de Bagdad" pueden haber sido utilizadas para rituales religiosos, con fines medicinales o incluso para galvanoplastia.
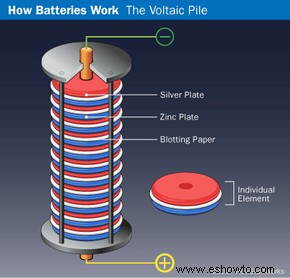
En 1799, el físico italiano Alessandro Volta creó la primera batería apilando capas alternas de zinc, cartón o tela empapados en salmuera y plata. Este arreglo, llamado pila voltaica , no fue el primer dispositivo en crear electricidad, pero fue el primero en emitir una corriente constante y duradera. Sin embargo, hubo algunos inconvenientes en el invento de Volta. La altura a la que se podían apilar las capas estaba limitada porque el peso de la pila exprimiría la salmuera del cartón o la tela. Los discos de metal también tendían a corroerse rápidamente, acortando la vida útil de la batería. A pesar de estas deficiencias, la unidad SI de fuerza electromotriz ahora se llama voltio en honor al logro de Volta.
 La historia de las baterías se remonta a 1800. Aprenda sobre la historia de las baterías y descubra cómo Daniell batería de celda está construida.
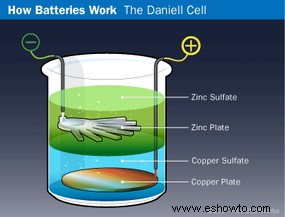
La historia de las baterías se remonta a 1800. Aprenda sobre la historia de las baterías y descubra cómo Daniell batería de celda está construida. El siguiente avance en la tecnología de las baterías se produjo en 1836, cuando el químico inglés John Frederick Daniell inventó la célula Daniell. . En esta primera batería, se colocaba una placa de cobre en el fondo de un frasco de vidrio y se vertía una solución de sulfato de cobre sobre la placa hasta llenar la mitad del frasco. Luego se colgó la placa de zinc en el frasco y se añadió una solución de sulfato de zinc. Debido a que el sulfato de cobre es más denso que el sulfato de zinc, la solución de zinc flotó hasta la parte superior de la solución de cobre y rodeó la placa de zinc. El cable conectado a la placa de zinc representaba la terminal negativa, mientras que el que salía de la placa de cobre era la terminal positiva. Obviamente, esta disposición no habría funcionado bien en una linterna, pero para aplicaciones estacionarias funcionó bien. De hecho, la celda Daniell era una forma común de alimentar timbres y teléfonos antes de que se perfeccionara la generación eléctrica.
En 1898, Colombia Dry Cell se convirtió en la primera batería disponible comercialmente vendida en los Estados Unidos. El fabricante, National Carbon Company, más tarde se convirtió en Eveready Battery Company, que produce la marca Energizer.
Ahora que conoce parte de la historia, haga clic en la siguiente página para conocer las distintas partes de una batería.
Anatomía de una batería
Eche un vistazo a cualquier batería y notará que tiene dos terminales . Un terminal está marcado (+), o positivo, mientras que el otro está marcado (-), o negativo. En las baterías de linterna normales, como las celdas AA, C o D, los terminales están ubicados en los extremos. Sin embargo, en una batería de automóvil o de 9 voltios, los terminales están situados uno al lado del otro en la parte superior de la unidad. Si conecta un cable entre los dos terminales, los electrones fluirán desde el extremo negativo al positivo lo más rápido que puedan. Esto desgastará rápidamente la batería y también puede ser peligroso, especialmente en baterías más grandes. Para aprovechar correctamente la carga eléctrica que produce una batería, debe conectarla a una carga . La carga puede ser algo como una bombilla, un motor o un circuito electrónico como una radio.
El funcionamiento interno de una batería generalmente se encuentra dentro de una caja de metal o plástico. Dentro de este estuche hay un cátodo , que se conecta al terminal positivo, y un ánodo , que se conecta al terminal negativo. Estos componentes, más generalmente conocidos como electrodos , ocupan la mayor parte del espacio en una batería y son el lugar donde ocurren las reacciones químicas. Un separador crea una barrera entre el cátodo y el ánodo, evitando que los electrodos se toquen y permitiendo que la carga eléctrica fluya libremente entre ellos. El medio que permite que la carga eléctrica fluya entre el cátodo y el ánodo se conoce como electrolito . Finalmente, el coleccionista conduce la carga al exterior de la batería y a través de la carga.
En la siguiente página, exploraremos cómo el cátodo, el ánodo, el electrolito, el separador y el colector trabajan juntos para producir una corriente eléctrica y mantener sus dispositivos portátiles en funcionamiento.
¿Sabías?Según una estimación de la EPA, los estadounidenses compran casi 3 mil millones de pilas secas cada año [fuente:EPA].
Reacciones y química de las baterías
Suceden muchas cosas dentro de una batería cuando la coloca en su linterna, control remoto u otro dispositivo inalámbrico. Si bien los procesos mediante los cuales producen electricidad difieren ligeramente de una batería a otra, la idea básica sigue siendo la misma.
Cuando una carga completa el circuito entre los dos terminales, la batería produce electricidad a través de una serie de reacciones electromagnéticas entre el ánodo, el cátodo y el electrolito. El ánodo experimenta una reacción de oxidación en el que dos o más iones (átomos o moléculas cargados eléctricamente) del electrolito se combinan con el ánodo, produciendo un compuesto y liberando uno o más electrones. Al mismo tiempo, el cátodo pasa por una reacción de reducción en el que la sustancia del cátodo, los iones y los electrones libres también se combinan para formar compuestos. Si bien esta acción puede parecer complicada, en realidad es muy simple:la reacción en el ánodo crea electrones y la reacción en el cátodo los absorbe. El producto neto es la electricidad. La batería continuará produciendo electricidad hasta que uno o ambos electrodos se queden sin la sustancia necesaria para que ocurran las reacciones.
Las baterías modernas utilizan una variedad de productos químicos para impulsar sus reacciones. Las químicas comunes de las baterías incluyen:
La mejor manera de entender estas reacciones es verlas por ti mismo. Vaya a la página siguiente para ver algunos experimentos prácticos con la batería.
¿Alimentado por aire?Los investigadores están desarrollando actualmente una batería en la que los electrodos serían de litio y, sorprendentemente, de oxígeno del aire. Tal avance reduciría drásticamente el peso de la batería y podría presumir de cinco a 10 veces la energía de las baterías de iones de litio tradicionales. Si bien esta tecnología aún tiene una serie de obstáculos que superar, algún día podría revolucionar la industria de los automóviles eléctricos [fuente:Rahim].
Experimentos con pilas:pila voltaica
Si desea obtener más información sobre las reacciones electroquímicas que ocurren en las baterías, puede construir una usted mismo utilizando materiales domésticos simples. Una cosa que debe comprar antes de comenzar es un medidor de voltios-ohmios económico ($10 a $20) en su tienda local de electrónica o ferretería. Asegúrese de que el medidor pueda leer voltajes bajos (en el rango de un voltio) y corrientes bajas (en el rango de cinco a 10 miliamperios). Con este equipo a mano, podrá ver exactamente qué tan bien está funcionando su batería.
Puede crear su propia pila voltaica utilizando monedas de veinticinco centavos, papel de aluminio, papel secante, vinagre de sidra y sal. Corta el papel de aluminio y el papel secante en círculos, luego sumerge el papel secante en una mezcla de vinagre de sidra y sal. Usando cinta adhesiva, adjunte un cable de cobre a uno de los discos de aluminio. Ahora apile los materiales en este orden:papel de aluminio, papel, cuarto, papel de aluminio, papel, cuarto, y así sucesivamente hasta que haya repetido el patrón 10 veces. Una vez que la última moneda esté en la pila, conéctela con un cable con cinta adhesiva. Finalmente, conecte los extremos libres de los dos cables a un LED, que debería encenderse. En este experimento, el cobre en el cuarto es el cátodo, la lámina es el ánodo, la solución de sal y vinagre de sidra es el electrolito y el papel secante es el separador.
También se puede hacer una batería casera con alambre de cobre, un clip y un limón. Primero, corte un trozo corto de alambre de cobre y enderece el clip. Use papel de lija para suavizar las partes ásperas en los extremos de cualquiera de las piezas de metal. A continuación, exprime suavemente el limón haciéndolo rodar sobre una mesa, pero ten cuidado de no romper la piel. Empuje el alambre de cobre y el clip en el limón, asegurándose de que estén lo más cerca posible sin tocarse. Finalmente, conecte su medidor de voltios-ohmios a los extremos del clip y el cable de cobre, y vea qué tipo de voltaje y corriente produce su batería.
A estas alturas ya debería estar bien familiarizado con los principios básicos por los cuales las baterías descargan electricidad. Siga leyendo para descubrir cómo se pueden recargar algunas baterías.
Gasvs. ElectricidadA pesar de todos sus inconvenientes, la gasolina sigue siendo el combustible predominante para los automóviles. ¿Por qué no se han puesto las pilas? Uno de los mayores problemas es con la densidad de energía:la cantidad de energía que un combustible puede almacenar en relación con su peso, que se mide en vatios-hora por kilogramo. La gasolina tiene una densidad de energía de alrededor de 13 000 vatios-hora por kilogramo, mientras que las mejores baterías de iones de litio actualmente disponibles pueden contener solo 200 vatios-hora por kilogramo [fuente:Manjoo].
Baterías recargables
Con el aumento de dispositivos portátiles como computadoras portátiles, teléfonos celulares, reproductores de MP3 y herramientas eléctricas inalámbricas, la necesidad de baterías recargables ha crecido sustancialmente en los últimos años. Las baterías recargables existen desde 1859, cuando el físico francés Gaston Plante inventó la celda de plomo-ácido. Con un ánodo de plomo, un cátodo de dióxido de plomo y un electrolito de ácido sulfúrico, la batería Plante fue un precursor de la batería de automóvil moderna.
Baterías no recargables o pilas primarias y baterías recargables, o pilas secundarias , producen corriente exactamente de la misma manera:a través de una reacción electroquímica que involucra un ánodo, un cátodo y un electrolito. En una batería recargable, sin embargo, la reacción es reversible. Cuando se aplica energía eléctrica de una fuente externa a una celda secundaria, el flujo de electrones de negativo a positivo que ocurre durante la descarga se invierte y se restaura la carga de la celda. Las baterías recargables más comunes en el mercado hoy en día son las de iones de litio. (LiOn), aunque hidruro metálico de níquel (NiMH) y níquel-cadmio Las baterías (NiCd) también fueron una vez muy frecuentes.
Cuando se trata de baterías recargables, no todas las baterías son iguales. Las baterías de NiCd se encontraban entre las primeras celdas secundarias ampliamente disponibles, pero sufrían un problema inconveniente conocido como el efecto memoria. . Básicamente, si estas baterías no se descargaran por completo cada vez que se usan, perderían capacidad rápidamente. Las baterías de NiCd se eliminaron en gran medida a favor de las baterías de NiMH. Estas celdas secundarias cuentan con una mayor capacidad y solo se ven mínimamente afectadas por el efecto memoria, pero no tienen una vida útil muy buena. Al igual que las baterías de NiMH, las baterías de LiOn tienen una vida útil prolongada, pero retienen mejor la carga, funcionan con voltajes más altos y vienen en un paquete mucho más pequeño y liviano. Esencialmente, toda la tecnología portátil de alta calidad fabricada en estos días aprovecha esta tecnología. Sin embargo, las baterías LiOn no están disponibles actualmente en tamaños estándar como AAA, AA, C o D, y son considerablemente más caras que sus contrapartes más antiguas.
Con las baterías de NiCd y NiMH, la carga puede resultar complicada. Debe tener cuidado de no sobrecargarlos, ya que esto podría conducir a una disminución de la capacidad. Para evitar que esto suceda, algunos cargadores cambian a carga lenta o simplemente se apagan cuando se completa la carga. Las baterías de NiCd y NiMH también deben reacondicionarse, lo que significa que debe descargarlas por completo y recargarlas de vez en cuando para minimizar cualquier pérdida de capacidad. Las baterías LiOn, por otro lado, tienen cargadores sofisticados que evitan la sobrecarga y nunca necesitan reacondicionamiento.
Incluso las baterías recargables eventualmente se agotarán, aunque pueden requerir cientos de cargas antes de que eso suceda. Cuando finalmente se agoten, asegúrese de desecharlos en una instalación de reciclaje.
A continuación, echemos un vistazo a la disposición de la batería.
Disposición y alimentación de la batería
 La disposición de la batería determina el voltaje y la corriente. Consulte los arreglos de batería en serie, los arreglos en paralelo y de qué se trata la corriente máxima.
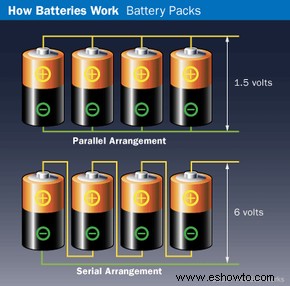
La disposición de la batería determina el voltaje y la corriente. Consulte los arreglos de batería en serie, los arreglos en paralelo y de qué se trata la corriente máxima. En muchos dispositivos que usan baterías, como radios portátiles y linternas, no usa solo una celda a la vez. Normalmente los agrupas en una serie acuerdo para aumentar el voltaje o en una disposición paralela para aumentar actual . El diagrama muestra estos dos arreglos.
El diagrama superior muestra una disposición en paralelo . Las cuatro baterías en paralelo producirán juntas el voltaje de una celda, pero la corriente que suministrarán será cuatro veces mayor que la de una sola celda. Actual es la velocidad a la que pasa la carga eléctrica a través de un circuito y se mide en amperios. Las baterías se clasifican en amperios-hora o, en el caso de baterías domésticas más pequeñas, miliamperios-hora (mAH). Una celda doméstica típica de 500 miliamperios-hora debería poder suministrar 500 miliamperios de corriente a la carga durante una hora. Puede rebanar y trocear la clasificación de miliamperios-hora de muchas maneras diferentes. Una batería de 500 miliamperios por hora también podría producir 5 miliamperios durante 100 horas, 10 miliamperios durante 50 horas o, en teoría, 1000 miliamperios durante 30 minutos. En términos generales, las baterías con índices de amperios por hora más altos tienen mayores capacidades.
El diagrama inferior muestra una disposición en serie . Las cuatro baterías en serie juntas producirán la corriente de una celda, pero el voltaje que suministrarán será cuatro veces mayor que el de una sola celda. Voltaje es una medida de energía por unidad de carga y se mide en voltios. En una batería, el voltaje determina la fuerza con la que se empujan los electrones a través de un circuito, al igual que la presión determina la fuerza con la que se empuja el agua a través de una manguera. La mayoría de las pilas AAA, AA, C y D tienen alrededor de 1,5 voltios.
Imagine que las baterías que se muestran en el diagrama tienen una capacidad nominal de 1,5 voltios y 500 miliamperios-hora. Las cuatro baterías en disposición paralela producirán 1,5 voltios a 2.000 miliamperios-hora. Las cuatro baterías dispuestas en serie producirán 6 voltios a 500 miliamperios-hora.
La tecnología de baterías ha avanzado dramáticamente desde los días de la pila voltaica. Estos desarrollos se reflejan claramente en nuestro acelerado mundo portátil, que depende más que nunca de la fuente de alimentación portátil que proporcionan las baterías. Uno solo puede imaginar lo que traerá la próxima generación de baterías más pequeñas, más potentes y más duraderas.
Para obtener más información sobre baterías y temas relacionados, consulte los enlaces a continuación.
Preguntas frecuentes sobre la batería
¿Qué es la energía de la batería?
La energía de una batería se expresa en vatios-hora (el símbolo Wh), que es el voltaje (V) que proporciona la batería multiplicado por la cantidad de corriente (amperios) que puede proporcionar durante un período de tiempo determinado (normalmente en horas).¿Cuáles son los diferentes tipos de baterías?
Las químicas (o tipos) de baterías comunes incluyen:zinc-carbono, alcalinas, de iones de litio (que son recargables) y de plomo-ácido (también recargables). Los investigadores también están desarrollando actualmente una batería de "aire" en la que los electrodos serían de litio y oxígeno del aire.¿Cuánto cuesta la batería de un coche?
Espere pagar entre $ 50 y $ 120 por una batería de automóvil típica y $ 90- $ 200 o más por una con una garantía más larga, mejor rendimiento en climas fríos o para usar en un vehículo de lujo.¿Cuál es la fuente de energía de una batería?
Las baterías crean energía a través de una reacción electroquímica. En pocas palabras, la reacción en el ánodo crea electrones y la reacción en el cátodo los absorbe. El producto neto es la electricidad.¿De qué tipo son las pilas recargables?
Las baterías recargables más comunes en el mercado son las de iones de litio (LiOn), aunque las baterías de hidruro metálico de níquel (NiMH) y las de níquel-cadmio (NiCd) también solían ser bastante frecuentes.Publicado originalmente:1 de abril de 2000
Más enlaces excelentes
Fuentes
Mucha más información
Más enlaces excelentes
Fuentes

